


Hidrokarbonlar
Hidrojen ve karbon olmak üzere iki elementten oluşan organik bir bileşiktir. Petrol bileşiminin büyük bir kısmı değişen uzunluklardaki hidrokarbonlardan oluşur.
En küçük hidrokarbon metan, tek bir karbon atomu ve dört hidrojen atomundan oluşur. Bununla birlikte, hidrokarbonlar, zincirler, daireler ve diğer karmaşık şekiller dahil olmak üzere birçok yönden birbirine bağlanmış yüzlerce veya binlerce bireysel atomdan oluşabilir.
Hidrokarbonların özelliklerini sınıflandırmak için birkaç temel türe ayrılırlar.
Alkanlar: Bunlar doymuş hidrokarbonlar olarak adlandırılır. Yani sadece tüm karbon atomları arasında tek bağlar içerirler. Alkanlar, petrol yakıtlarının temelidir ve doğrusal ve dallı formlarda bulunurlar.
Doymamış Hidrokarbonlar: Karbon atomları arasında bir veya daha fazla çift bağa sahip olan hidrokarbonlara alken denir.
Sikloalkanlar: Bir veya daha fazla halka yapısı içeren herhangi bir hidrokarbon.
Aromatik Hidrokarbonlar: Areneler olarak da adlandırılan aromatik hidrokarbonlar, karbon atomlarının birbirini izleyen çift ve tek bağlarla bağlandığı benzersiz bir karbon molekülleri sınıfıdır. Bu molekül sınıfı, karbon atomları arasındaki bağların tek ve çift bağlar arasında bir ara bağ olduğu özel halka yapılarına sahiptir.
Bu sınıftaki moleküller, endüstriyel çözücü «benzen» içerir.
Benzen (C6H6): Diğer hidrokarbonlar gibi benzen de petrolün doğal bir bileşenidir. Oda sıcaklığında renksiz, yanıcı, tatlı kokulu bir sıvıdır ve yüksek oktan sayısına sahip olduğu için çoğu benzin karışımının bir bileşenidir.
Benzen de oldukça kanserojendir ve kemik iliği yetmezliği ve kemik kanserine neden olduğu iyi bilinmektedir. Elbette, “hoş aroması” nedeniyle tıraş sonrası ve diğer kozmetiklerde bir katkı maddesi olarak kullanıldığında kanserojenliği iyi bilinmemektedir.
En büyük benzen kullanımı (% 50), stiren ve polistren plastiklerinin ürünüdür. Ayrıca Naylon üretiminde önemli olan sikloheksan olarak bilinen bir moleküle dönüştürülür. Siklohekzan üretmek için benzenin yaklaşık% 15'i kullanılır. Böcek ilaçlarından kauçuğa kadar her şeyde daha küçük miktarlar kullanılır.
Benzen yapısı iki şekilde çizilebilir. İlkinde, çift bağ karakteri açıkça çizilir. Kısa elli versiyonda, yapıyı göstermek için halkanın içine bir daire çizilir. Benzen içindeki her bir karbon atomuna bağlı tek bir hidrojen vardır.
Aşağıdaki I. ve II. çizimleri eştir. Pratikte III. çizim kullanılır.
Benzen, renksiz, alevlenebilen, kaynama noktası 80,1 °C, erime noktası 5,5 °C olan bir sıvıdır.
Binükleer Aromatik Hidrokarbonlar: Molekülünde iki benzen halkası içeren bileşiklerdir.
Hidrokarbonlar
Hidrojen ve karbon olmak üzere iki elementten oluşan organik bir bileşiktir. Petrol bileşiminin büyük bir kısmı değişen uzunluklardaki hidrokarbonlardan oluşur.
En küçük hidrokarbon metan, tek bir karbon atomu ve dört hidrojen atomundan oluşur. Bununla birlikte, hidrokarbonlar, zincirler, daireler ve diğer karmaşık şekiller dahil olmak üzere birçok yönden birbirine bağlanmış yüzlerce veya binlerce bireysel atomdan oluşabilir.
Hidrokarbonların özelliklerini sınıflandırmak için birkaç temel türe ayrılırlar.
Alkanlar: Bunlar doymuş hidrokarbonlar olarak adlandırılır. Yani sadece tüm karbon atomları arasında tek bağlar içerirler. Alkanlar, petrol yakıtlarının temelidir ve doğrusal ve dallı formlarda bulunurlar.
Doymamış Hidrokarbonlar: Karbon atomları arasında bir veya daha fazla çift bağa sahip olan hidrokarbonlara alken denir.
Sikloalkanlar: Bir veya daha fazla halka yapısı içeren herhangi bir hidrokarbon.
Aromatik Hidrokarbonlar: Areneler olarak da adlandırılan aromatik hidrokarbonlar, karbon atomlarının birbirini izleyen çift ve tek bağlarla bağlandığı benzersiz bir karbon molekülleri sınıfıdır. Bu molekül sınıfı, karbon atomları arasındaki bağların tek ve çift bağlar arasında bir ara bağ olduğu özel halka yapılarına sahiptir.
Bu sınıftaki moleküller, endüstriyel çözücü «benzen» içerir.
Benzen (C6H6): Diğer hidrokarbonlar gibi benzen de petrolün doğal bir bileşenidir. Oda sıcaklığında renksiz, yanıcı, tatlı kokulu bir sıvıdır ve yüksek oktan sayısına sahip olduğu için çoğu benzin karışımının bir bileşenidir.
Benzen de oldukça kanserojendir ve kemik iliği yetmezliği ve kemik kanserine neden olduğu iyi bilinmektedir. Elbette, “hoş aroması” nedeniyle tıraş sonrası ve diğer kozmetiklerde bir katkı maddesi olarak kullanıldığında kanserojenliği iyi bilinmemektedir.
En büyük benzen kullanımı (% 50), stiren ve polistren plastiklerinin ürünüdür. Ayrıca Naylon üretiminde önemli olan sikloheksan olarak bilinen bir moleküle dönüştürülür. Siklohekzan üretmek için benzenin yaklaşık% 15'i kullanılır. Böcek ilaçlarından kauçuğa kadar her şeyde daha küçük miktarlar kullanılır.
Benzen yapısı iki şekilde çizilebilir. İlkinde, çift bağ karakteri açıkça çizilir. Kısa elli versiyonda, yapıyı göstermek için halkanın içine bir daire çizilir. Benzen içindeki her bir karbon atomuna bağlı tek bir hidrojen vardır.
Aşağıdaki I. ve II. çizimleri eştir. Pratikte III. çizim kullanılır.
Benzen, renksiz, alevlenebilen, kaynama noktası 80,1 °C, erime noktası 5,5 °C olan bir sıvıdır.
Binükleer Aromatik Hidrokarbonlar: Molekülünde iki benzen halkası içeren bileşiklerdir.
Hakkında
Kyäni, faydalı bileşenlerden oluşan besin takviyesi ürünlerini; benzersiz iş fırsatıyla birlikte dünya çapında 50'den fazla ülkeye ulaştırmaktadır. İdeal sağlığımızı korumak için günlük olarak Kyäni ürünlerini kullanırız, bu ürünleri başkalarıyla paylaşırız, işimizi inşa etmek ve sürdürmek için neredeyse her gün belirli bir saatimizi işe adarız ve başkalarını da Kyäni fırsatına dahil ederek veya Potato Pak ve Caring Hands programlarına katkı sağlayarak başarımızı başkalarıyla paylaşırız.
Hakkında
Kyäni, faydalı bileşenlerden oluşan besin takviyesi ürünlerini; benzersiz iş fırsatıyla birlikte dünya çapında 50'den fazla ülkeye ulaştırmaktadır. İdeal sağlığımızı korumak için günlük olarak Kyäni ürünlerini kullanırız, bu ürünleri başkalarıyla paylaşırız, işimizi inşa etmek ve sürdürmek için neredeyse her gün belirli bir saatimizi işe adarız ve başkalarını da Kyäni fırsatına dahil ederek veya Potato Pak ve Caring Hands programlarına katkı sağlayarak başarımızı başkalarıyla paylaşırız.
Sayfa Yapım Aşamasındadır.
Sayfa Yapım Aşamasındadır.
Schulungs- / Wissens- / Lösungsplattform

Kohlenwasserstoffe
Es ist eine organische Verbindung, die aus zwei Elementen besteht, Wasserstoff und Kohlenstoff. Der größte Teil der Erdölzusammensetzung besteht aus Kohlenwasserstoffen unterschiedlicher Länge. Das kleinste Kohlenwasserstoffmethan besteht aus einem einzelnen Kohlenstoffatom und vier Wasserstoffatomen. Kohlenwasserstoffe können jedoch aus Hunderten oder Tausenden einzelner Atome bestehen, die auf vielfältige Weise miteinander verbunden sind, einschließlich Ketten, Kreisen und anderen komplexen Formen. Um die Eigenschaften von Kohlenwasserstoffen zu klassifizieren, werden sie in verschiedene Grundtypen unterteilt.
Struktur von Kohlenwasserstoffen
Da Kohlenwasserstoffe nur aus Kohlenstoff und Wasserstoff bestehen, kann ihre Verbrennung mit Sauerstoff nur durch die Kombination von Wasserstoff und Sauerstoff und Kohlendioxid durch die Kombination von Kohlenstoff und Sauerstoff Wasser erzeugen. Die Energie, die durch Verbrennen eines Kohlenwasserstoffs erzeugt wird, resultiert aus dem Aufbrechen von Kohlenstoff-Wasserstoff- und Kohlenstoff-Kohlenstoff-Bindungen und deren Rekombination in Kohlenstoff-Sauerstoff- und Wasserstoff-Sauerstoff-Bindungen. Die Struktur, das Verhältnis von Wasserstoff zu Kohlenstoff und die Länge eines bestimmten Kohlenwasserstoffs bestimmen seine Eigenschaften. Im Allgemeinen sind kleine Kohlenwasserstoffe Gas, während mittelgroße lineare Kohlenwasserstoffe flüssig sind. Zwischenverzweigte Kohlenwasserstoffe sind Wachse mit niedrigem Schmelzpunkt. Lange Kohlenwasserstoffe neigen dazu, halbfest oder fest zu sein. Ungesättigte Kohlenwasserstoffe sind mit größerer Wahrscheinlichkeit starrer als ihre gesättigten Gegenstücke wie cyclische Kohlenwasserstoffe.
Kohlenwasserstoffe mit bis zu 10 Kohlenstoffatomen und ihre Verwendungsbereiche sind in der Tabelle aufgeführt.
Kohlenwasserstoffe mit mehr als 10 Kohlenstoffatomen werden in einem als "Cracken" bekannten Prozess häufig in Strukturen mit kürzeren Längen zerlegt.
Ungesättigte Kohlenwasserstoffe: Kohlenwasserstoffe mit einer oder mehreren Doppelbindungen zwischen Kohlenstoffatomen werden als Alkene bezeichnet.
Cycloalkane: Jeder Kohlenwasserstoff, der eine oder mehrere Ringstrukturen enthält.
Aromatische Kohlenwasserstoffe: Aromatische Kohlenwasserstoffe , auch Arene genannt, sind eine einzigartige Klasse von Kohlenstoffmolekülen, in denen Kohlenstoffatome durch aufeinanderfolgende Doppel- und Einfachbindungen gebunden sind. Diese Klasse von Molekülen hat spezielle Ringstrukturen, bei denen die Bindungen zwischen Kohlenstoffatomen eine Zwischenbindung zwischen Einfach- und Doppelbindungen sind.
Benzol (C6H6): Benzol ist wie andere Kohlenwasserstoffe ein natürlicher Bestandteil von Erdöl. Es ist eine farblose, brennbare, süß riechende Flüssigkeit bei Raumtemperatur und ist aufgrund seiner hohen Oktanzahl Bestandteil der meisten Benzinmischungen.
Benzol ist auch stark krebserregend und verursacht bekanntermaßen Knochenmarkversagen und Knochenkrebs. Natürlich ist seine Karzinogenität als Additiv in Aftershave und anderen Kosmetika aufgrund seines "angenehmen Aromas" nicht gut bekannt.
Die größte Verwendung von Benzol (50%) ist das Produkt aus Styrol- und Polystyrolkunststoffen. Es wird auch in ein Molekül umgewandelt, das als Cyclohexan bekannt ist und für die Nylonproduktion wichtig ist. Etwa 15% Benzol werden zur Herstellung von Cyclohexan verwendet. Kleinere Mengen werden in allen Bereichen verwendet, von Pestiziden bis hin zu Gummi.
Die Benzolstruktur kann auf zwei Arten gezeichnet werden. Im ersten wird der Doppelbindungscharakter explizit gezeichnet. In der Shorthanded-Version wird ein Kreis innerhalb des Rings gezeichnet, um die Struktur zu zeigen. In Benzol ist nur ein Wasserstoff an jedes Kohlenstoffatom gebunden.
Nach den Benzolringdarstellungen; I. und II. Zeichnungen sind identisch. III in der Praxis. Zeichnung wird verwendet.
Benzol ist eine farblose, brennbare Flüssigkeit mit einem Siedepunkt von 80,1 ° C und einem Schmelzpunkt von 5,5 ° C. Als Ausgangsmaterial bei der Synthese von Styrol und Phenol zur Kunststoffherstellung in der Industrie, in Nylonkomponenten , synthetisch in der Waschmittelherstellung verwendet. In Flugbenzin wird das Ausgangsmaterial von Anilin , das zum Lackieren verwendet wird, und Benzol als Insektizid verwendet. Benzol ist auch ein gutes Lösungsmittel.


Alkane: (CnH2n + 2)
Alkane sind auch als Paraffin bekannt. Dieser Begriff ist ziemlich verwirrend, da sich Paraffin auch auf eine Art Wachs bezieht. Alkane werden gesättigte Kohlenwasserstoffe genannt. Das heißt, sie enthalten nur Einfachbindungen zwischen allen Kohlenstoffatomen. Alkane sind die Basis von Erdölbrennstoffen und liegen in linearer und verzweigter Form vor.
Im Allgemeinen haben die in diesem Wachs verwendeten Alkane Kohlenstoffketten von 20 bis 40 Kohlenstoffen. Somit ist Paraffinwachs ein Wachs aus Paraffin oder Alkanen. Paraffinwachs zeichnet sich durch einen niedrigen Schmelzpunkt, eine flexible Struktur und ein leichtes Verbrennen aus. Wird normalerweise in Kerzen und Buntstiften verwendet.
Alkane enthalten nur Einfachbindungen, dh sie sind mit Wasserstoffatomen gesättigt.
Alkane haben ihren Namen von der Alkylgruppe, die aus einem Kohlenstoff und drei Wasserstoffatomen besteht.
Methan: (CH4) Es ist der einfachste Kohlenwasserstoff, der aus einem Kohlenstoff und vier Wasserstoffmolekülen besteht. Da es sehr klein ist, ist es bei Raumtemperatur ein farbloses, geruchloses Gas. Der Geruch in "Erdgas", der in Haushalten verwendet wird, wird aus Sicherheitsgründen tatsächlich zu Methan hinzugefügt.
Es ist der Kohlenwasserstoff mit dem kleinsten Molekulargewicht, (CH4) ist ein farbloses Gas; auch als Sumpfgas bekannt. Methan ist der Grundstoff von Erdgas.
Methan ist eine tetraedrische Form (Pyramide mit dreieckiger Basis), bei der jeder Wasserstoff gleich allen anderen Wasserstoffatomen ist. Methan wird häufig als Brennstoff zur Stromerzeugung und -heizung verwendet. In komprimierter Form wird es als Fahrzeugkraftstoff verwendet. Methan verbrennt häufig mit hoher Effizienz und produziert nur geringe Mengen an Kohlenmonoxid. Es kommt auf natürliche Weise in Erdöl, Steinkohlevorkommen, Erdgas und Sümpfen vor. Methan, das auch zur Stromerzeugung verwendet wird, weist ebenfalls die geringste Kohlendioxidemission auf.


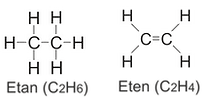
Ethan: (C2H6) hat zwei Kohlenstoffmoleküle und sechs Wasserstoffmoleküle. Kohlenstoffmoleküle sind durch eine Einfachbindung miteinander verbunden und haben jeweils drei Wasserstoffatome. Ethan ist wie Methan bei Raumtemperatur ein farbloses, geruchloses Gas. Ethan wird hauptsächlich zur Herstellung von Ethylen und als Brennstoff verwendet. Es wird auch zur Herstellung von Ethylen, Acetaldehyd und Essigsäure verwendet. Es wird auch für chemische Anwendungen wie Polyethylen (ein Polymer aus Ethylen und dem weltweit am häufigsten verwendeten Kunststoff) sowie zur Herstellung von Ethylenglykol, dem Hauptbestandteil des Frostschutzmittels, verwendet.

Propan: (C3H8) Nebenprodukt der Erdgasaufbereitung und Erdölraffinierung. In Gasform ist es schwerer als Luft. Propan ist ein sehr sauberer Kraftstoff, der bei der Verbrennung hauptsächlich Wasser und Kohlendioxid produziert. Wenn sich Propan ausdehnt, nimmt es Wärme auf und kann als Kühlmittel wirken, ist jedoch explosiv. Es wird in Sprays als Treibmittel verwendet. Es wird auch zum Befüllen von Industriekühlern und Thermostaten verwendet. Propangas ist ein Gas, das sich unter niedrigem Druck verflüssigen kann. Aufgrund dieser Eigenschaft wird es mit Butangas gemischt und als Brennstoff in Haushalten und ländlichen Gebieten verwendet.

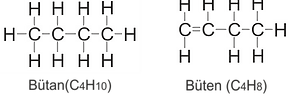
Butan: (C4H10) Es ist ein Gas mit vier Kohlenstoffatomen. Wie Propan ist es dichter als Luftgas. Es wird auch als Aerosol-Treibmittel verwendet. Butan ist euphorisch (entspannt Emotionen und Muskeln) und wird daher häufig als flüchtige Substanz missbraucht. Es verursacht Krämpfe in den Atemwegsmuskeln in der Lunge. Es erscheint meist als leichteres Gas und Aerosol.

Pentan: (C5H12) Wird normalerweise als Lösungsmittel und manchmal als Kraftstoff verwendet. Es ist eine Flüssigkeit bei Raumtemperatur und farblos, verdunstet aber leicht. Tatsächlich kocht Pentan bei einer Körpertemperatur von 37 ° C. Pentan ist in Benzinmischungen enthalten, wird jedoch im industriellen Umfeld hauptsächlich als "Gebläse" bei der Bildung von Polystyrol-Kunststoffschäumen verwendet. Isopentan wird in Zahnpasten wie Aquafresh und Sensodyne verwendet.

Hexan: (C6H14) Dieses Molekül ist ein wichtiger Bestandteil von Benzin und riecht nach Benzin anders. Asphalttat wird in Lösungsmittelformulierungen, zur Herstellung von Lederprodukten und Dächern verwendet. Es ist ungiftig und wird zur Extraktion von Ölen aus Getreide und Nüssen verwendet. Im Allgemeinen kann Hexan jedoch nach der Verarbeitung in Lebensmitteln verbleiben. Hexan ist leichter zu finden, obwohl Heptan oder Octan das Öl besser auflösen. Da Hexandampf schwerer als Luft ist, kann er sich auf dem Boden ausbreiten und über große Entfernungen eine Entzündung verursachen. Hexan wird zur Herstellung von Schuhen, Leder, Dachbeschichtungen und Leim verwendet.

Heptan: (C7H16) Wird als Lösungsmittel verwendet, da es als Kraftstoff unbrauchbar ist. Es ist ein wichtiger Bestandteil von Gummizement. Es wird als Lösungsmittel in Farben, zum Auflösen von Pigmenten und sogar zum Färben sowie in schnell trocknenden Klebstoffen verwendet. Sein Schmelzpunkt beträgt –90,61 ° C und sein Siedepunkt beträgt 98,42 ° C. Heptan ist der Hauptbestandteil von Benzin.

Oktan: (C8H18) Oktan ve izomerleri, benzinin başlıca bileşenleridir. İzo-oktanın, benzinin oktan değerini artıran şey olduğunu unutmamak önemlidir. Diğer hidrokarbonlar, tolüen ve metil tersiyer butil eter (MTBE) dahil olmak üzere oktan derecelendirmelerini arttırmak için de kullanılabilir. Dimetilbenzen ve etilbenzenin aromatizasyonunda kullanılır. Çözücü olarak faydalanılır.

Nonan: (C9H20) hat 35 verschiedene Isomere. Aufgrund seiner hohen Entflammbarkeit wird es nur in Kraftstoff verwendet. Seine Hauptverwendung ist Kerosin. Es wird manchmal als Lösungsmittel und als Träger bei der Herstellung von Paraffin (Wachs) sowie bei der Herstellung und Destillation von Tensiden verwendet.

Dean: (C10H22) Kohlenwasserstoffe gelten als das letzte Mitglied dieser Serie, obwohl es noch viele weitere gibt. Das Dekan hat 75 verschiedene Isomere und sie sind alle brennbar. Es wird hauptsächlich als Kraftstoff und Lösungsmittel verwendet. Es wird als Referenz in der Gaschromatographie angesehen.

Andere: (C11H24 Undecan), (C12H26 Dodecan) (C13H28 Tredecan),
(C14H30 Tetradecan) (C20H42 Eicosan), (C21H44 Heneikozan) (C22H46 Dokozan), (C30H62 Tricontan) (C40H82 Tetracontan), (C50H102 Pentacontan)
Alkene: (CnH2n)
Alkene werden auch Olefine genannt. Wie bei Alkanen kann dies verwirrend sein, da es auch ein Olefinmaterial gibt.
Wie im Fall von Paraffinwachs und Alkanen ist Olefin eine Art Faser, die nur aus Alkenen hergestellt wird. Olefin besteht normalerweise aus Polypropylen oder Polyethylen und wird in allen Bereichen verwendet, vom Seil bis zur Fahrzeuginnenausstattung.
Die Doppelbindungsstruktur von Alkenen verändert ihre Chemie im Vergleich zu Alkanen. Erstens sind Alkene saurer als Alkane. Sie sind auch reaktiver als Alkane und gehen leicht Polymerisationsreaktionen ein. Alkene sind ungesättigt, was bedeutet, dass sie mindestens eine Kohlenstoff-Kohlenstoff-Doppelbindung enthalten.
Diese Doppelbindung ersetzt zwei Wasserstoffatome; Dies bedeutet, dass Alkene nicht die maximale Anzahl von Wasserstoffatomen pro Kohlenstoff aufweisen und daher als ungesättigt bezeichnet werden.
Alkene verflüssigen sich, wenn sie 15 oder mehr Kohlenstoffatome haben oder wenn sie mehr als fünf Kohlenstoffatome und Feststoffe enthalten.
Olefinverbindungen sind in Rohöl fast nicht vorhanden und werden durch Verfahren wie thermisches oder katalytisches Cracken hergestellt. Diese Gruppe von Verbindungen sind aufgrund der Doppelbindung in ihren Molekülen wichtige petrochemische Zwischenprodukte und Monomere.
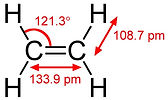
Ethylen (oder Ethylen) ist der einfachste Alkenkohlenwasserstoff, der zwei Wasserstoffatome enthält, die jeweils mit zwei doppelt gebundenen Kohlenstoffatomen an jeden Kohlenstoff gebunden sind. C2H4. Das Molekül kann sich nicht um die Doppelbindung drehen, daher befinden sich alle sechs Atome in derselben Ebene.
Eten (Ethylen): (C2H4) Eten ist das kleinste Alkenelement. Es ist ein farbloses Gas bei Raumtemperatur. Manchmal ist es technisch falsch, es als "Ethylen" zu bezeichnen, aber diese Definition wurde verwendet, weil es Teil einer gemeinsamen Parität ist. Ethan ist eine sehr wichtige Industriechemikalie. Erstens ist es der Grundrohstoff für die Herstellung von Polyethylenkunststoffen. Aus Polyethylen wird alles hergestellt, von Einkaufstüten bis hin zu Verpackungsmaterialien, Schmiermitteln und sogar einigen Reinigungsmitteln. Mehr als die Hälfte der gesamten Ethanproduktion wird für die Polyethylenproduktion verwendet. Polyethylen wird in einem Verfahren hergestellt, das hochreines Ethan und einen Metallkatalysator erfordert. Pyrolysebenzin aus Ethylencracköfen besteht hauptsächlich aus C5- und schwereren (C5 +) Kohlenwasserstoffen (siehe PE-Polymerisation)


Propen (Propylen): (C3H6) Propylen (oder Propen) ist nach Ethylen das einfachste Alkenmolekül; C3H6 Es ist bei Raumtemperatur und Druck gasförmig, farblos und hat einen spezifischen Geruch. Es kommt in Kohlengas vor und wird durch Cracken von Erdgas oder Öl gewonnen. Propen ist ein farbloses Gas mit einem schwachen, aber unangenehmen Geruch, der als etwas süß beschrieben wurde. Es ist ein Nebenprodukt der Erdölraffination, kann aber auch im Labor hergestellt werden. Propen dient als Rohprodukt für eine Reihe von Industriechemikalien. Am wichtigsten ist, dass es zu Polypropylen polymerisiert werden kann, das zwei Drittel des gesamten verwendeten Propans ausmacht. Polypropylenseile sind der Hauptbestandteil einer Reihe von Textilien, einschließlich Teppichen und thermischer Unterwäsche. Propend wird auch zur Herstellung von Aceton und Isopropylalkohol (Reinigungsalkohol) verwendet. Die Herstellung von Polypropylen erfolgt auf die gleiche Weise wie die Herstellung von Polyethylen.



Buten (Butylen): ( C4H8) Buten ist ein farbloses Gas, das vier Strukturisomere (verschiedene Formen) mit jeweils leicht süßen Gerüchen enthält. Seine Hauptanwendung ist die Herstellung von Polymeren für synthetische Kautschukreifen. Isobutylenisomer wird zur Herstellung von Methyl-tert.-butylether (MBTE) verwendet, das Benzin zur Unterstützung von Octan zugesetzt wird.
Alkene auf Butan werden häufig in kleinere Strukturen zur Verwendung bei der Herstellung von Polymeren wie Polyethylen und Polypropylen unterteilt. Die Ausnahme ist Hepten, das in einigen Schmiermitteln als Additiv verwendet wird.
E - Z Isomere
Wenn ein Alken mehr als einen Substituenten hat, wird die Doppelbindungsgeometrie unter Verwendung von E- und Z-Tags beschrieben. Diese Tags kommen von den deutschen Wörtern entgegen, was "Gegenteil" bedeutet, und zusammen, was "zusammen" bedeutet.
Die geschlossenen Formeln der Isomere sind gleich, die dreidimensionale Anordnung der Atome im Raum ist unterschiedlich.
Im EZ-Isomer werden die Positionen der großen Primärgruppen verglichen, die an die Atome gebunden sind, die die (=) -Bindung bilden.

Z-Bütan:

E Bütan:
Alkine: (CnH2n-2)
Die Formel des kleinsten Alkins lautet C2H2 und der spezifische Name dieser Verbindung lautet Acetylen. Aus diesem Grund werden Alkine auch als Acetylene bezeichnet.
Wenn in einem Kohlenwasserstoff mindestens eine Dreifachbindung zwischen zwei Kohlenstoffen besteht, gehört der betreffende Kohlenwasserstoff zur Klasse der Alkine. Der Bindungswinkel beträgt 180 ° C. Die ersten drei Mitglieder sind Gas, die letzteren sind flüssig. Sie sind wasserunlöslich. Flüssige haben eine geringere Dichte als Wasser. Dem allgemeinen Trend folgend, dass Alkene reaktiver als Alkane sind, sind Alkine reaktiver als Alkene, was sie zur reaktivsten der drei Grundklassen von Kohlenwasserstoffen macht.
Fleisch (Acetylen): (C2H2) Diese beiden Kohlenstoffmoleküle sind farblose Gase, die im reinen Zustand außergewöhnlich instabil sind. Es ist aber auch in einigen industriellen Umgebungen nützlich. Es kann verarbeitet werden, ohne sich aufzulösen, normalerweise durch Mischen mit anderen Bestandteilen. Es ist explosiv, weil es hochreaktiv ist. Zu den Hauptanwendungen von Acetylen gehört die Umwandlung in Ethylen und eine Base von Acrylsäuren als Verbrennungskomponente beim Acetylenschweißen und zur Herstellung von Polyethylen.

Propin (Methylacetylen): (C3H4) Es ist ein Acion mit drei Kohlenstoffatomen, das auch ein farbloses Gas ist. Es wird beim Schweißen als Alternative zu Acetylen verwendet, da es für Versand und Lagerung sicher zu einer Flüssigkeit kondensiert werden kann. Es ist das Ausgangsmaterial für verschiedene chemische Verbindungen wie Propylen, Polypropylenkunststoffe und Acrylnitril, Isopropylalkohol, Propylenoxid; Es ist auch eine wertvolle Petrochemie, die bei der Herstellung von Benzin verwendet wird, und ein sehr wichtiges Polymer, das bei der Herstellung verschiedener Materialien in unserem Leben verwendet wird (z. B. Automobilbaustoffe, Verpackungen und elektronische Materialien). Propin wurde auch für die Verwendung als Raketentreibstoff für Raumfahrzeuge erforscht, die für eine erdnahe Umlaufbahn bestimmt sind.
Sein größter Vorteil ist, dass Propin im Gegensatz zu Wasserstoff eine Flüssigkeit bleibt, ohne dass eine kryogene Speicherung erforderlich ist.

Prozesse
Büten-1 Produktionsprozess:
Buten-1 wird aus Ethylen durch die selektive Dimerisierungsreaktion erhalten. Das Katalysatorsystem ist ein Derivat von Titan und verhindert die Isomerisierung von Buten-1 zu Buten-2.
Das Polymerisationsreinheitsethylen wird in dem Verfahren verwendet. Das Alfabutol-Verfahren ist einfach. Da die Arbeitstemperatur niedrig ist (50-60 ° C), ist im Reaktionsabschnitt kein Heizmedium erforderlich; Halten Sie die Reaktanten in flüssiger Phase
ein niedriger Arbeitsdruck reicht aus für Verwenden Sie Lösungsmittel für die Reaktion und den Prozess.
unzerstörbar; Es sind keine speziellen oder teuren Materialien erforderlich (nur Konstruktion
Kohlenstoffstahl verwendet wird). Ethylen mit Polymerisationsreinheit (in gasförmiger Form) wird unter Flüssigphasenbedingungen durch ein Dispergiermittel in den Reaktor eingespeist. Der Katalysator wird kontinuierlich in die Reaktorlösung eingeführt, wo Ethylen in der flüssigen Phase die Dimerisierungsreaktion eingeht. Die Reaktionswärme wird durch ein herkömmliches luft- oder wassergekühltes Pumpsystem abgeführt. Das Produkt wird vom Boden des Reaktors entnommen; Es liegt in flüssiger Form vor und wird mit verbrauchtem Katalysator gemischt.
Der verbrauchte Katalysator im Produktstrom wird im Katalysatorentfernungsabschnitt abgetrennt und
weggeworfen (zum Beispiel zur Verbrennungsanlage geschickt); Kohlenwasserstoffe werden durch Fraktionierung geteilt.
geht. Hier gibt es zwei Spalten. Im ersten wird nicht umgesetztes Ethylen abgetrennt und in den Reaktor zurückgeführt. Reines Buten-1 wird vom Kopf der zweiten Säule und Oligomere (vorwiegend C6-Olefin) vom Boden genommen.
Büten-2 Produktionsprozess:
Es ist ein Verfahren, bei dem Buten-2 und Ethylen durch Reaktion von Triolefin aus Propylen hergestellt werden. Propylen von Ethylen und Nbutylenen; oder andere Triolefinverfahren, bei denen Ethylen-, Propylen- und C5-C7-Olefine aus Butylenen erhalten werden.
Das Propylen (und das zurückkehrende Propylen) wird erhitzt und fließt in den Festbettmetatreaktor.
gefüttert. Im Metathesereaktor werden 2 Mol Propylen in 1 Mol Ethylen und 1 Mol Buten-2 umgewandelt. Die geringe Menge an Koks, die sich auf dem Katalysator ansammelt, wird durch einen periodischen Regenerationsprozess gereinigt. Der Reaktorstrom gelangt zur Fraktionierungssäule; Wenn sich Ethylen abscheidet, kehrt nicht umgesetztes Propylen zurück und das Butylenprodukt geht in die nächste Fraktionierung über. Das recycelte Propylen trennt sich von dem in der vorherigen Fraktionierungssäule enthaltenen Propan und gelangt in den Reaktor. Die geringe Menge an C5 + -Olefinen, die bei der Reaktion gebildet werden, wird vom Butylenstrom abgetrennt und Butylen wird von der Oberseite des Arms entfernt.
Kommerziell reines (93%) Propylen, 30% Ethylen, 58% Butylene (90% Buten-2), 9%
Propan-Nebenprodukt (80% Propan) und
Man erhält 3% C5 + Gewichte.
Propylen wird durch Pyrolyse hergestellt oder von der Raffinerie geliefert; seine Konzentration kann über einen weiten Bereich variieren. Je höher die Propylenkonzentration im Beschickungsstrom ist, desto höher ist der Wirkungsgrad.
Alkoholproduktionsprozess:
Ethylen, Aluminium, Wasserstoff, Lösungsmittel, Luft- und Wasserethylierung, Oxidation und
Es ist ein Prozess, bei dem geradkettige Alpha-Alkohole durch Hydrolysereaktionen hergestellt werden.
Dabei entsteht auch sehr reines Aluminiumoxid oder Alaun als Nebenprodukt.
Aluminiumpulver wird als Aufschlämmung in einem geeigneten Lösungsmittel gemischt und
Es wird mit trockenem Wasserstoff in der Umgebung mit Triethylaluminium (TEA) hydriert. Das resultierende Produkt, Diethylaluminiumhydrid, reagiert mit Ethylen unter Bildung von Triethylaluminium. Für jedes in die Polymerisation eingebrachte Mol werden 2 Mol Triethylaluminium in die Hydrierungsstufe zurückgeführt.
(TEA) reagiert mit Ethylen unter Bildung von Alkylaluminien mit hohem Molekulargewicht. Durch Zersetzung nach der Polymerisation wird eine Mischung von Alkylketten von C2 bis C22 erhalten. Die proliferative Reaktion ist sehr exotherm; Da die Proliferationskette und (TEA) heftig mit Wasser reagieren, wird die freigesetzte Wärme von einem Kohlenwasserstoff übertragen. Die Reaktion wird bei hohem Druck und niedriger Temperatur durchgeführt, um eine optimale Effizienz zu erzielen.
Das wachsende Produkt wird durch Oxidation mit trockener Luft unter kontrollierten Bedingungen in Alkoxide umgewandelt. Die Oxidationsreaktion ist sehr exotherm und ergibt Ester, Ether, Oxide, Aldehyde als Nebenprodukte; Diese werden vor der Hydrolyse mit einem Überschuss an Lösungsmittel entfernt.
Hydrolyse: Gereinigtes Alkoxid wird durch Reaktion mit Wasser in rohe Alkohole und Aluminiumoxidschlamm umgewandelt. Nach einem Reinigungsprozess wird Wasser durch Trocknen abgetrennt und 75% Al 2 O 3 CATAPAL-Aluminiumoxid mit hoher Reinheit erhalten. Wenn eine hochreine Alaunlösung gewünscht wird, wird die Hydrolysereaktion mit 98% iger Schwefelsäure durchgeführt.
Fraktionierung: Rohe Alkohole werden getrocknet und destilliert; Durch Fraktionierung kann jeder Alkohol einzeln erhalten oder als binäre Gemische gesammelt werden. Alkohole mit hohem Molekulargewicht werden im Vakuum destilliert.
Ammoniak-Produktionsprozess:
Es ist ein Prozess, bei dem Ammoniak durch Methanisierungsreaktion aus Erdgas gewonnen wird. Andere Kohlenwasserstoffe können ebenfalls als Rohstoffe verwendet werden.
Nach dem Mischen mit dem zurückgeführten Wasserstoff wird das Erdgas erhitzt und zum Entschwefelungsgerät geschickt, um es zu entschwefeln, durch das der Sättiger läuft; Während des Erhitzens des aus dem Speisetank kommenden Erdgases kühlt es sich etwas ab.
Im Sättiger mischt es sich mit dem heiß zirkulierenden Prozesskondensat, dem austretenden Strom,
Das Dampf / Kohlenstoff-Verhältnis beträgt 2,8 / 1, gemischt mit etwas mehr Dampf und heiß
Das Gas wird durch Vorheizen im ersten Reformer auf eine Temperatur von 700-800 ° C und einen Druck von 28-45 bar gebracht. Das Gasgemisch wird einer zweiten Reformereinheit und dem Prozess zugeführt
durch die Luft erwärmt, erreicht hier seine Temperatur 900-950 ° C. Heißes Gas wird gekühlt
(Erzeugung von überhitztem Hochdruckgas) und Eintritt in Hochtemperatur- (HT) und Niedertemperatur- (LT) Wandler (5,6); In diesen Einheiten wird der größte Teil des Kohlenmonoxids zu Kohlendioxid. Der Kühlprozess des Prozessgases in HT- und LT-Wandlern erfolgt durch Erhitzen des dem Sättiger zugeführten Zirkulationswassers.
Die Wärme des aus dem LT-Wandler austretenden Gases wird zum Vorheizen des Hochdruckkesselspeisewassers (BFW = Kesselspeisewasser) genutzt.
Das aus dem LT-Wandler austretende kalte Gas wird in eine CO2-Entfernungseinheit geleitet;
von hier direkt zum Synthesegaskompressor und dann zum Methanator
Aufwand. Dieses Layout minimiert den Bedarf an Außenwärme. Das Prozessgas wird getrocknet und gelangt zur Syntheseeinheit. Herkömmliche Katalysatoren werden bei der Syntheseherstellung verwendet. Jede Ammoniak-Konvertereinheit kann verwendet werden. Nachdem die aus dem Konverter austretenden heißen Gase durch Hochdruckkesselspeisewasser und Konverterspeisegas gekühlt wurden, gelangen sie zur Kühleinheit, aus der Ammoniak in reiner Form gewonnen wird. Der Seitenstrom vom Zirkulator gelangt zu einer einfachen Kühleinheit. Hier kondensieren die nicht umgesetzten Teile und werden als Kraftstoff verwendet, während der Wasserstoff zur Umwälzpumpe zurückkehrt.
Die Produktionspreise hängen vom Erdgaspreis und vom Kapital ab. Die Kosten für Rohmaterial und Hilfsmaterial (Kraftstoff) variieren je nach Flussdiagramm des Werks und des geografischen Standorts.
Ammoniumnitrat-Produktionsprozess:
Es ist ein Verfahren, bei dem Ammoniumnitrat durch Neutralisationsreaktion von Salpetersäure mit Ammoniak erhalten wird; Das Produkt ist eine 99,8 Gew .-% ige Ammoniumnitratlösung (AN). Im Carnit-Prozess wird keine externe Wärme benötigt, die Energieeffizienz ist hoch und das Kapital ist niedrig.
Salpetersäure und Ammoniakgas reagieren in einem hochreversiblen Durchflusssystem.
eingefügt; Der Arbeitsdruck wird höher gehalten als der Dampfdruck der Lösung. Es wird kein Prozessdampf erzeugt. Durch Einstellen der Rücklaufrate wird der Lösungsrücklauf (durch eine Reihe von Wärmetauschern) gekühlt, wobei die Temperatur unter Kontrolle gehalten wird. Die Heißrücklauflösung verlässt den Reaktor bei 185-190 ° C und fließt in den Wärmetauscher, wo sie ihre Wärme abgibt. Diese Wärme wird zur Herstellung einer 99,8% igen Produktlösung verwendet. Andere Modifikatoren im System sind Verdampfer, die mit 95% iger Lösung Exportdampf abgeben. Im System
Die Lösung ist leicht Ammoniak. Freies Ammoniak im Produkt wird durch Injektion einer kleinen Menge Salpetersäure vor der Druckreduzierung neutralisiert. Der Carnitprozess ist durch einen isobaren Konzentrationsprozess gekennzeichnet.
Druckreduzierung und Selbstregulierung des adiabatischen Strahls. Es gibt keinen Gasfluss; Der Ammoniumnitratgehalt des Flüssigkeitsstroms liegt bei 400 Gewichtsprozent. Die eigene Energie des Prozesses reicht bis zu 45% iger Säurelösung aus; Es werden höhere Konzentrationen an Exportdampf erhalten.
Anilin-Produktionsprozess:
Es ist eine Reaktion aus Phenol, bei der Anilin durch die Ammonolysereaktion erzeugt wird.
Nachdem das aus dem Tank entnommene Phenol mit überschüssigem Ammoniak gemischt wurde, wird es verdampft, erhitzt und einem adiabatischen Festbettreaktor zugeführt. Mit dem Katalysator im Reaktor reagieren Phenol und Ammoniak unter Bildung von Anilin und Wasser. Der den Reaktor verlassende Gasstrom wird teilweise kondensiert, die flüssige und die gasförmige Phase werden getrennt. Die Gasphase ist nicht umgesetztes Ammoniak; es wird komprimiert und recycelt. Der flüssige Teil wird destilliert, nachdem das Ammoniak entfernt wurde und sehr reines Anilin erhalten wird. Eine kleine Menge nicht umgesetztes Phenol wird als Anilin-Phenol-Azeotrop gewonnen und in die Reaktion zurückgeführt. Das wichtigste Merkmal des Verfahrens ist der Halcon SD-Katalysator; Phenol bis stöchiometrische Effizienz
wandelt sich sehr nahe in Ammoniak um. Daher ist der Reinigungsprozess sehr einfach und das resultierende Anilin ist außergewöhnlich rein. Die Lebensdauer eines Katalysators beträgt ziemlich lange, etwa sieben Jahre.
Ein weiteres Merkmal des Verfahrens besteht darin, die Anteile der Reaktanten zu ändern.
ist zu erlauben. Somit ist eine vorherrschende Produktion des Nebenprodukts Diphenylamin möglich. Ein zusätzliches Reinigungssystem ist erforderlich, um sehr reines Diphenylamin zu erhalten. Selbst in einem solchen Betriebszustand ändert sich die Lebensdauer des Katalysators nicht.
Das erforderliche Kapital ist viel geringer als bei Technologien, die auf der Basis der Nitrobenzolreduktion arbeiten. Für 12,6 Millionen Dollar (1985) wurde eine Fabrik mit einer Kapazität von 50 000 t / Jahr gegründet. Übermäßiger Phenolgehalt, bei dem eine sehr reine Anilinproduktion erwünscht ist
Dieses Verfahren wird bevorzugt, wenn mit einer geringen Kapitalmenge produziert werden soll. Ein weiterer Vorteil der Verwendung von Phenol als Rohmaterial besteht in der gefährlichen Nitrierungsreaktion und Säurereinigungsstufe, die bei herkömmlichen Technologien auf Benzolbasis zu finden sind.
es ist der Mangel an Mesin. Daher gibt es nur sehr wenige Abfallprobleme.
Produktionsverfahren für Polyethylen:
Hochdruckgasphasenpolymerisation aus Ethylen, niedrige Dichte
Es ist ein Kalkprozess, bei dem Polyethylen erhalten wird.
Ethylengas wird zuerst im Frontkompressor auf 250-300 Atmosphären komprimiert, das zweite
an den Kompressor gesendet. Druck hier
Es wird auf 3500 Atmosphären erhöht. Der Druck des Reaktors hängt von der Konstruktion der Fabrik, der Art des Katalysators und der Qualität des gewünschten Produkts ab. Das komprimierte Ethylen wird nach einem Vorheizen im Rohrreaktor polymerisiert. Nicht umgesetztes Ethylen am Ausgang des Reaktors wird mit mittlerem und niedrigem Druck zu zwei Abscheidern geschickt. Dieses Ethylen wird über einen Booster zum Vorabscheider und zum zweiten Kompressor zurückgeführt.
Das resultierende Polyethylen wird einem Extruder zugeführt; Hier werden notwendige Zusätze hinzugefügt und das Endprodukt granuliert. Aufgrund des verwendeten Reaktortyps ist die Polymerisationsgeschwindigkeit sehr hoch. Die Kosten für Hilfsstoffe wie Wasser, Dampf und Strom sind gering und die Betriebsflexibilität außergewöhnlich. Die Qualität des erhaltenen Produktes ist sehr gut. Fabriken sind so konstruiert, dass sie absolut sicher arbeiten.
LLDPE-Produktionsprozess:
Es ist ein Verfahren, bei dem lineares Polyethylen niedriger Dichte und Polyethylen hoher Dichte durch Gasphasenpolymerisation bei niedrigem Druck aus Ethylen erhalten werden. In einem Fließbettreaktor können unter Verwendung geeigneter fester Katalysatoren Gasphasenpolyethylene hergestellt werden, die einen weiten Bereich abdecken. Das Produkt ist trocken, fließt leicht und liegt in Form von Granulaten vor, die keine feinen Partikel enthalten. Schmelzindex und Molekulargewicht
Seine Verteilung wird durch die Wahl spezifischer Katalysatoren und Betriebsbedingungen gesteuert. Die Dichte des Polymers im Produkt
eingestellt durch die Menge an Comonomer. Die Katalysatoreffizienz ist sehr hoch; Diese Eigenschaft eliminiert eine Katalysatortrennung nach der Reaktion.
Das Merkmal des Prozesses minimiert die Umweltverschmutzung, die Brand- und Explosionsgefahr.
hält gerade; Daher ist es sehr einfach zu bedienen und zu warten.
Gasethylen, Comonomer und Katalysator werden in den Reaktor gegeben; im Reaktor wächst
es gibt ein Fließbett, das durch Polymerteilchen gebildet wird; 20 kg / cm²
Druck und arbeitet um 100 ° C. Das in das Reaktionsbett strömende Reaktionsgas wird von einem einstufigen Radialverdichter umgewälzt; Somit ist die Polymerisationsreaktion
Während das notwendige Rohmaterial bereitgestellt wird, wird dem Bett Reaktionswärme entzogen.
Das Zirkulationsgas wird durch einen Wärmetauscher gekühlt. Das körnige Produkt fließt intermittierend in die Produktentleerungstanks. Hier wird nicht umgesetztes Gas vom Produkt getrennt. Das extrahierte Gas wird komprimiert und in den Reaktor zurückgeführt. Im Produkt verbleibende Kohlenwasserstoffe werden mit Stickstoff weggespült. Das körnige Produkt wird in einem Niedrigenergiesystem zu Pellets geformt.
Die Dichte des Polymers kann leicht im Bereich von 0,915 bis 0,970 gesteuert werden.
Die Molekulargewichtsverteilung ist relativ zum Katalysator eng oder mittelgroß.
Der Schmelzfluss kann von 1 bis über 200 variiert werden.
Nichtkohlenwasserstoffkomponenten von Erdöl
Neben Kohlenwasserstoffen, die aus Kohlenstoff und Wasserstoff bestehen, gibt es auch Verbindungen, die einige andere Elemente in Rohöl enthalten. Diese Elemente werden Heteroatome ("andere Atome") genannt. Es ist kein zusammengesetzter Kohlenwasserstoff mit Heteroatomen, gebundenem Kohlenstoff und Wasserstoff. Die wichtigsten in Rohöl vorkommenden Heteroatome sind Schwefel und Stickstoff sowie sehr wenig Vanadium, Nickel, Natrium und Kalium.
Schwefelverbindungen
Die Art und Menge der Schwefelverbindungen variieren je nach Standort des Rohöls zwischen 2 und 6 Gew .-%. Rohöl mit mehr als 1% gelöstem Schwefelwasserstoff wird als „saures“ Erdöl eingestuft. Schwefelverbindungen haben ihren eigenen unangenehmen Geruch, wodurch sie sofort erkannt werden und es einfacher ist, diese Verbindungen zu vermeiden, die besonders gesundheitsschädlich sind.
In Rohöl liegt Schwefel entweder als Schwefelwasserstoff (H2S), als Verbindungen (z. B. Mercaptane, Sulfide, Disulfide, Thiophene usw.) oder als elementarer Schwefel vor und weist eine schlechte thermische Stabilität auf. Beim Raffinieren zerfallen sie in Schwefelwasserstoff und einfache organische Schwefelverbindungen. Mercaptane werden durch Ersetzen eines Wasserstoffatoms in Schwefelwasserstoff durch eine Kohlenwasserstoffgruppe gebildet; Sie entstehen bei der Destillation von Rohöl. Wenn zwei Wasserstoffatome in Schwefelwasserstoff durch Kohlenwasserstoffgruppen ersetzt werden, werden Schwefelverbindungen gebildet; wie Thiophen (C4H4S). Die Schwefelverbindungen in jedem Rohöl unterscheiden sich in Menge und Art, aber ihre Mengen in ihren schweren Fraktionen sind stabiler und komplexer.
Schwefelwasserstoff ist der wichtigste Zustand, der Korrosion in Raffinerieprozesseinheiten verursacht. Andere ätzende Verbindungen sind elementarer Schwefel und Mercaptane. Ätzende Schwefelverbindungen riechen schlecht.
Pyrophores Eisensulfat entsteht durch die korrosive Wirkung schwefelhaltiger Verbindungen auf Eisen- und Stahlmaterialien, die beim Bau von Raffinerieausrüstungen, Rohrleitungssystemen und Tanks verwendet werden. Unerwünschte Substanzen wie Schwefelsäure und Schwefeldioxid werden durch Verbrennung von Erdölprodukten freigesetzt, die schwefelhaltige Verbindungen enthalten.

Sauerstoffhaltige Verbindungen
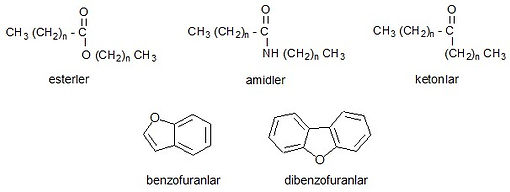
In Erdöl vorkommende sauerstoffhaltige Verbindungen sind recht komplex und die Strukturen einiger von ihnen sind noch nicht vollständig definiert. Es ist bekannt, dass bei der Destillation von Erdöl einige Verbindungen unter Bildung von cyclischen Strukturen, sogenannten Naphthensäuren, mit Carbonsäuren in ihren Seitenketten abgebaut werden und einige phenolische Verbindungen am Ende von Crackprozessen gefunden werden. Unter Verwendung der aus Raffinerieströmen erhaltenen Daten wurde festgestellt, dass die meisten sauerstoffhaltigen Verbindungen in Erdöl komplexe Carbonsäuren, Phenole und Kresole sind und nicht saure Verbindungen wie Ester, Amide, Ketone und Benzofurane weniger vorhanden sind. Asphalte enthalten sauerstoffreiche Verbindungen.
Da die meisten von ihnen sauer sind, müssen sauerstoffhaltige Verbindungen aus dem Rohöl und seinen Fraktionen entfernt werden. Der Gesamtsäurewert von Rohöl kann zwischen 0,03 und 3% variieren. Da S und N in den Strömen für katalytische Prozesse unter Kontrolle gehalten werden, stellen sauerstoffhaltige Verbindungen kein signifikantes Problem dar.
Saure sauerstoffhaltige Verbindungen:
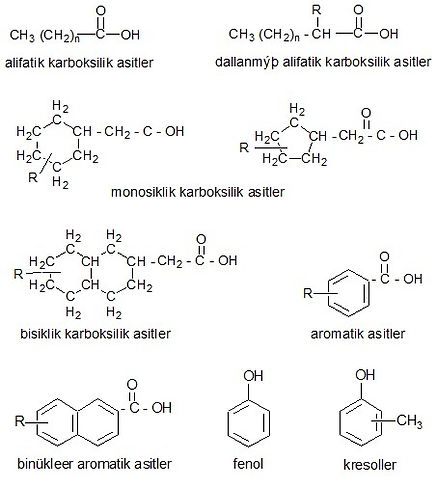
Asidik olmayan oksijenli bileşikler:
Stickstoffhaltige Verbindungen
Die meisten Rohöle enthalten weniger als 0,1 Gew .-% Stickstoff. Da stickstoffhaltige Verbindungen hitzebeständig sind, werden sie in Spuren in leichten Raffinerieströmen gefunden, während sie eher in hochsiedenden Fraktionen vorliegen. Stickstoff liegt in Form von basischen Verbindungen in leichten Fraktionen vor, in den schwereren Fraktionen ist er meist nicht basisch und kann Spuren von Cu, V, Ni-Metallen enthalten. In den Prozessöfen entstehen Stickoxide. Bei katalytischen Crack- und Hydrocrackprozessen entstehen Ammoniak und Cyanide durch Zersetzung von Stickstoffverbindungen und verursachen toxische Wirkungen auf Katalysatoren. Daher werden die Ströme, die katalytischen Prozessen zugeführt werden, durch den Hydrotreating-Prozess geleitet, wodurch der Stickstoffgehalt auf harmlose Werte reduziert wird.

Für detailliertere Informationen über: Prof.Dr. Bilsen Beşergil
Sie können die Blog-Seite (Celâl Bayar University) hier erreichen.
